[일반화학실험] 23. 화학 반응 속도 실험 보고서(레포트)
1. 목표
화학 반응 속도식의 속도 상수와 반응 차수를 실험적으로 결정한다.
2. 실험 기구&시약
- 시약 : 3% H2O2, 0.15M KI
- 기구 : 250㎖ 삼각플라스크, 물통, 기체 부피 측정관 또는 50㎖ 뷰렛, 수위 조절 용기 또는 비커, 25㎖ 눈금 실린더, 10㎖ 눈금 피펫 또는 10㎖ 눈금 실린더, 온도계, 고무관과 고무 마개 2개, 초시계, 시험관
3. 실험 원리
(1) 반응 속도
- 화학 반응 속도는 반응 물질의 종류, 반응 물질의 농도, 온도, 촉매 등 여러 가지 요인에 의해 영향을 받음
- 반응 속도는 단위 시간에 감소한 반응물 또는 증가한 생성물의 몰농도로 나타낸다.

- 평균 반응 속도 : 전체 농도의 변화를 반응이 진행된 전체 시간으로 나눈 것
- 순간 반응 속도 :
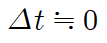
이 되는 어떤 특정한 순간의 반응 속도, 시간-농도 그래프에서 접선의 기울기
(2) 반응 속도식(속도 법칙)과 반응 차수
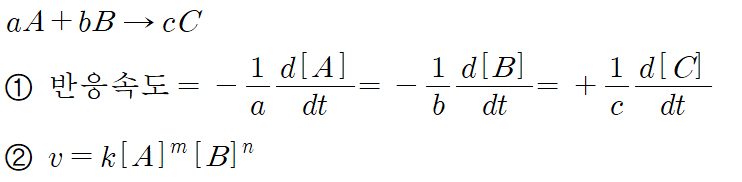
- 용액 : 적정을 하거나 흡광도나 전기 전도도, 또는 형광 등을 측정해 시간에 따른 농도의 변화를 측정할 수 있음
- 기체 : 일정한 압력에서 부피의 변화를 측정할 수 있음
- 이때 m과 n을 반응차수라고 한다.
(3) 속도상수와 아레니우스식
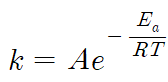
- k : 속도상수
- A : 아레니우스 상수
- Ea : 활성화 에너지
- R : 기체 상수
- T : 절대 온도
(4) 적분 속도식


(5) 반응 메커니즘
반응물이 서로 만나 생성물로 변환되는 과정에서는 반응물이나 생성물보다 상대적으로 불안정한 활성화물이 생성된다. 이 활성화물이 만들어지기 위해서는 충분한 에너지를 가진 반응물의 분자들이 많이 있어야 한다.
(6) 활성화 에너지 : 반응이 일어나기 위해 필요한 최소한의 에너지, 활성화 에너지가 클수록 반응 속도는 느려지게 된다.
(7) 실험 반응 : 과산화수소(H2O2)가 물과 산소 기체로 분해되는 반응의 속도를 측정한다.
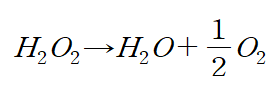
이 분해 반응의 속도는 매우 느리기 때문에 상온에서는 잘 일어나지 않지만 KI를 촉매로 넣어주면 반응의 속도가 상당히 빨라진다.
반응속도 :
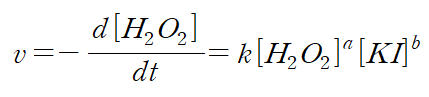
- 이 실험에서는 과산화 수소의 분해 반응으로 생기는 산소 기체의 양을 측정해서 시간에 따른 산소 기체의 발생량을 그래프로 나타내어서 그 기울기로부터 반응 속도를 알아낸다.
- 반응이 충분히 진행 된 후에는 반응 용기 속의 반응 물질의 농도가 바뀌기 때문에 반응 속도도 달라지게 되므로 이 실험에서는 반응이 시작된 직후의 속도를 측정해서 원하는 정보를 알아낸다.
- 초기의 반응 속도 = 그래프의 시작부분에서의 기울기
③ 반응 차수 결정
- 이 실험에서는 H2O2와 KI의 초기 농도가 다른 경우의 반응 속도를 측정해서 그 결과로부터 반응 차수를 알아낸다.
- 반응 물질의 전체 양을 일정하게 하면 반응에 사용한 용액의 부피를 농도로 사용할 수 있으며, 이 실험에서는 다음과 같은 세 가지 반응 용액의 부피를 초기 농도로 사용한다.
| 3% H2O2 (mL) | 0.15M KI (mL) | 증류수 (mL) | 전체 부피 (mL) | |
| 반응1 | 5 | 10 | 15 | 30 |
| 반응2 | 10 | 10 | 10 | 30 |
| 반응3 | 5 | 20 | 5 | 30 |
속도식은 각각 다음과 같이 표현할 수 있다.
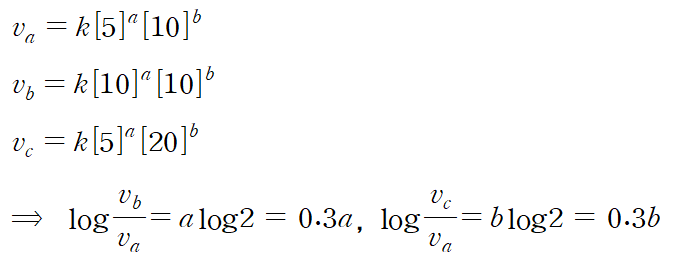
따라서 반응 물질의 농도가 서로 다른 경우의 반응 속도 세 가지를 측정하면 반응 차수 a와 b를 계산할 수 있다.
4. 실험 유의점
- H2O2의 분해 반응은 심한 발열 반응이기 때문에 진한 과산화수소 용액을 사용하는 것은 바람직하지 않다.
- 0.15M KI 용액은 학급 전체에 필요한 양을 미리 만들어 라벨을 붙여 놓는다.
- 기체 포집 장치가 새지 않는지 확인한다.
- 피펫은 각 용액별로 따로 사용한다. 피펫 수가 모자라면 깨끗이 씻어 물기를 제거한 다음 다른 용액을 취한다.
- 사용한 용액은 과량의 물로 희석하여 버린다.
5. 실험 과정
- 반응 용기와 기체의 부피를 측정하는 장치를 준비한다. 기체 부피를 측정하는 관은 50㎖ 뷰렛을 사용해도 된다. 뷰렛의 위쪽에는 기체가 새어나가지 않도록 연한 고무 마개를 사용한다.
- 물통에 3~5cm 높이까지 물을 채우고 온도계를 설치한 후, 기체 부피 측정관의 고무 마개를 열고 물을 가득 채운다. 수위 조절 용기의 높이를 조절해서 물 높이가 측정관에 새겨진 눈금의 가장 높은 곳에 오도록 한 후에 마개를 완전히 닫는다. 측정관의 연결부위가 새지 않는가를 확인하고 물 높이를 읽어서 기록한다.
- 반응 용기에 0.15M KI 10㎖와 증류수 15㎖를 넣고 흔들어주어서 혼합물의 온도가 물통에 담긴 물의 온도와 같아지도록 한다. 3% H2O2 용액 5㎖를 넣고 마개를 막은 다음 잘 흔들어준다. 체온 때문에 반응 용기의 온도가 올라가지 않도록 반응 용기의 끝부분만 잡는 것이 좋다.
- 약 2㎖의 산소가 발생될 때부터 시간을 재기 시작한다. 발생한 기체에 작용하는 압력이 일정한 상태에서 산소 기체의 부피를 측정해야 하기 때문에 수위 조절 용기의 높이를 기체 부피 측정관의 물 높이에 따라서 움직이면서 산소 기체의 부피를 측정해야 한다. 산소 기체가 2㎖씩 생성될 때마다 걸린 시간을 측정하는 일을 산소 기체의 부피가 14㎖가 될 때까지 반복한다.
- 다시 반응 용기를 씻은 다음 0.1M KI 20㎖와 증류수 5㎖에 3% H2O2 용액 5㎖를 첨가해서 위의 실험을 반복한다.
6. 실험결과
1. 산소 발생에 걸린 시간(초)
(초로 측정하였음)
| 산소의 부피(㎖) | 혼합물 A | 혼합물 B | 혼합물 C |
| KI 10㎖ | KI 10㎖ | KI 20㎖ | |
| 3% H2O2 5㎖ | 3% H2O2 10㎖ | 3% H2O2 5㎖ | |
| 증류수 15㎖ | 증류수 10㎖ | 증류수 5㎖ | |
| 2.0 | - | - | - |
| 4.0 | 27.08 | 26.40 | |
| 6.0 | 33.53 | 12.22 | |
| 8.0 | 41.82 | 20.13 | |
| 10.0 | 48.56 | 35.99 | |
| 12.0 | 52.67 | 38.77 | |
| 14.0 | 58.26 | 41.72 |
2. 초기 반응 속도
초기 반응속도는 산소 부피가 2mL에서 4mL로 변할 때의 속도를 구하면 된다.
따라서 아래 식에서 [O2]에 2를 대입해 반응 속도를 구하면 표와 같다.
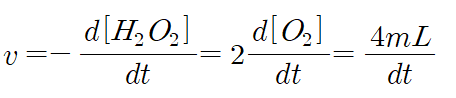
| 산소의 부피(㎖) | 혼합물 A | 혼합물 B | 혼합물 C |
| 초기 반응 속도 | 0.1447 mL/s | 0.2668 mL/s | 0.1669 mL/s |
3. 반응 차수와 속도식
a (H2O2에 대한 반응 차수) : 1
b (KI에 대한 반응 차수) : 1
반응 속도식 : v=k[H2O2][KI]
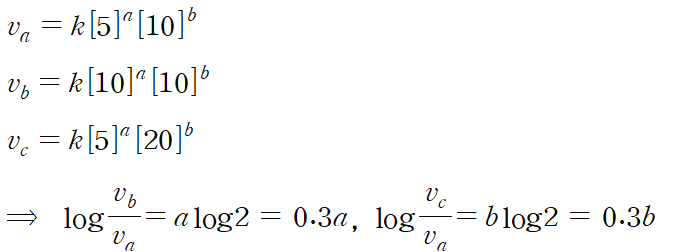
이론값으로 a=b=1로 알려져 있다. 실험데이터 값을 구하면 대략 1.0xx 정도가 나올 것이다.
4. 반응 용액의 전체 부피가 같을 경우에는 사용한 반응 물질의 부피를 반응 물질의 농도 대신 사용할 수 있는 이유를 설명해 보아라.
몰농도는 몰수/부피이다. 전체 용액의 부피가 같을 경우에는 몰농도는 몰수에 비례한다. 몰수는 결국 사용한 반응물의 부피에 비례하므로 사용한 반응물의 부피를 물질의 농도 대신 사용할 수 있다.
5. 반응 차수에 따라 속도 상수의 단위가 달라짐을 알아보아라.
속도 상수는 속도 법칙에 맞는 단위를 가지므로 반응차수에 따라 그 단위가 달라질 수 있다.
1) 1차 반응일 경우
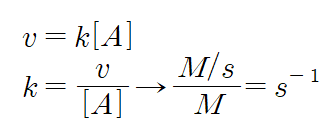
2) 2차 반응일 경우
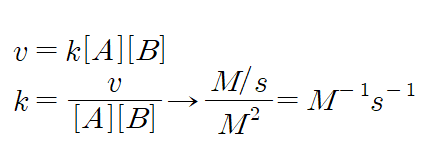
6. 반응 A보다 반응 B와 C의 온도가 더 높았다면 결과에 어떤 영향을 미치겠는가?
아레니우스식에 의하면 온도가 증가할수록 반응차수가 커진다. 따라서 반응A보다 반응B, C에서의 k가 더 큰 값을 가져 반응차수를 정확히 구하기가 힘들 것이다.
7. H2O2의 분해 반응에 촉매로 작용하는 물질은 어떤 것들이 있는가 알아보자.
카탈레이스 H3PO4, MnO2, NaBr