[일반화학실험] 24. 시계반응 실험(반응속도에 미치는 농도의 영향) 레포트 (보고서
1. 목표
시계 반응을 이용해서 반응 속도의 차이가 큰 반응 단계가 연속적으로 일어나는 화학 반응의 특성을 알아본다.
2. 기구&시약
- 시약 : 삼각 플라스크 50 mL, 100 mL, 피펫 5 mL, 10 mL, 20 mL, 눈금 실린더 10 mL, 온도계 (1~100 ℃), 스톱워치, 스포이드, 씻기병, 고무채우게
- 시약 : 0.20M KI, 0.10M (NH4)2S2O8, 0.005M Na2S2O3, 0.20M KCl, 0.10M (NH4)2SO4, 녹말 지시약
(시약조사는 따로 안함)
3. 원리
(1) 시계 반응 : 반응 속도 결정 단계가 포함된 메커니즘으로 일어나는 반응에서 정해진 양의 반응물이 모두 반응하고 난 뒤 색깔을 띠어서 반응에 소요된 시간을 알려주는 반응
(2) 대표적인 아이오딘 시계 반응
① NaHSO3와 KlO3의 반응
일정한 온도에서 NaHSO3 용액의 농도를 변화시키면서 일정 농도의 KlO3 용액과 반응시켰을 때(또는 그 반대도 가능), 생성된 아이오딘(I2)이 용액 속에 넣어둔 녹말과 반응하여 청자색이나 갈색이 나타나는 순간까지의 시간을 측정함으로써 반응 속도를 비교할 수 있다.


② KI와 (NH4)2S2O8의 반응 - 표준일반화학실험반응



4. 유의사항
- 두 용액의 온도를 일정하게 한 후에 반응 속도를 측정한다.
- 피펫의 용액은 남아 있지 않도록 해야 하며 사용하던 시험관, 피펫 등을 바꿔 사용하지 않도록 한다.
- 소량을 희석할 경우 눈금 실린더를 사용하기보다는 피펫으로 필요한 만큼의 증류수를 첨가하는 것이 오차가 작다.
- 이 실험은 일정한 온도에서 해야 한다.
- 진한 청색이 나타날 때까지 걸리는 시간은 1분 이내이다.
- 녹말 지시약은 2 g의 수용성 녹말을 HgCl2(방부제) 5mg과 함께 물 1 L에 넣고 가열해서 녹말을 모두 녹인 후에 식혀서 사용한다.
- (NH4)2S2O8 용액은 오래 방치하면 분해되므로 사용 직전에 만드는 것이 가장 좋다.
5. 실험 과정
| 반응 | 100mL 삼각 플라스크 | 50mL 삼각 플라스크 | ||
| 1 | 10.0mL | 0.20M KI | 10.0mL | 0.10M (NH4)2S2O8 |
| 2 | 5.0mL | 0.20M KI | 10.0mL | 0.10M (NH4)2S2O8 |
| 5.0mL | 0.20M KCl | |||
| 3 | 10.0mL | 0.20M KI | 5.0mL 5.0mL |
0.10M (NH4)2S2O8 0.10M (NH4)2SO4 |
| 4 | 10.0mL | 0.20M KI | 2.5mL 7.5mL |
0.10M (NH4)2S2O8 0.10M (NH4)2SO4 |
| 5 | 4.0mL 6.0mL |
0.20M KI 0.20M KCl |
10.0mL | 0.10M (NH4)2S2O8 |
| 6 | 7.5mL 2.5mL |
0.20M KI 0.20M KCl |
7.5mL 2.5mL |
0.10M (NH4)2S2O8 0.10M (NH4)2SO4 |
- 실험 결과를 얻기 위해서는 다음의 반응 혼합물 중에서 적어도 3가지 이상의 실험을 해야 한다. 피펫을 사용해서 100mL 삼각 플라스크와 50mL 삼각 플라스크에 용액을 정확하게 측정해서 넣는다. KI와 (NH4)2S2O8 용액의 부피는 피펫으로 정확하게 측정해야 하지만, KCl과 (NH4)2SO4용액은 눈금 실린더로 측정해도 된다.
- 100mL 플라스크에 온도계를 넣고, 초까지 읽을 수 있는 시계를 준비한다.
- 100mL 플라스크에 0.005M Na2S2O3 용액 5.00mL를 정확하게 측정해서 넣고, 녹말 지시약 몇 방울을 넣는다.
- 50mL에 담긴 용액을 손실이 없도록 조심해서 재빨리 100mL 플라스크에 붓고, 반응 시작 시간을 기록하거나 스톱워치를 작동시키고, 잘 흔들어준다.
- 용액이 진한 청색으로 바뀔 때까지 걸리는 시간을 측정해서 기록하고, 용액의 온도를 기록한다.
- 다른 혼합물을 넣기 전에 플라스크를 깨끗이 씻고 가능한 한 물기를 없애는 것이 좋다.
6. 실험 결과
| 반응 혼합물 | 변색까지 걸린 시간(t) | [I-] | [S2O8^2- ] | 상대 반응 속도(100/t) |
| 1 | 50S | 0.20M * 10.0 / 15.0 = 0.133M | 0.10M | 2.00 s^-1 |
| 2 | 93S | 0.20M * 5.0/15.0 = . .667M |
0.10M | 1.08 s^-1 |
| 3 | 147S | 0.20M * 10.0 / 15.0 = 0.133M |
0.10M * 5.0/10.0 = 0.050M | 1.47 s^-1 |
- 실험 결과 처리
- 반응 혼합물에서 처음에 넣어준 [I-]와 [S2O8^2- ]의 농도를 계산한다.
- 용액이 청색으로 변할 때까지 걸리는 시간은 용액에 넣어준 싸이오황산 이온이 모두 없어질 만큼의 I3-가 만들어질 때까지 걸리는 시간이다. 따라서 반응 속도는 측정한 시간의 역수에 비례하게 된다.
- 3가지 이상의 실험 결과를
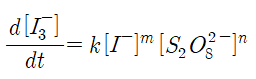
에 넣어주면 속도 상수 k와 반응 차수 m, n을 얻을 수 있다. 예를 들어서 1번의 속도를 2번의 속도로 나누어준 결과와 1번의 속도를 3번의 속도로 나누어준 결과를 이용하면 m과 n을 얻을 수 있고, 이 값을 이용하면 각각의 반응 혼합물에서의 속도 상수 k를 결정할 수 있다. 이 경우에 반응 차수는 정수가 되어야 한다. 가능하면 많은 종류의 반응 혼합물을 이용한 실험을 해서 m, n, k 값을 얻고, 속도 상수는 평균값을 기록한다.

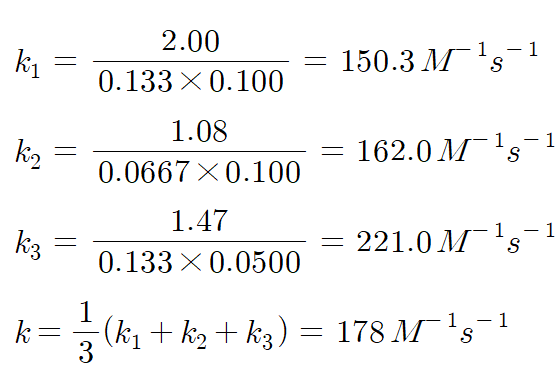
COMMENT)
유효숫자 두 자리로 맞추면 m과 n이 약 1에 가까이 나올 것 같습니다.
이상적인 실험결과를 맞추기 위해 반응차수를 정수로 표현했지만, 실제로 실험을 하다보면 정수로 나오지 않고 소수점까지 나오는데 이 소수점을 정수로 맞추지 말고 모두 표현해주는 것이 정확하다고 하니 참고바랍니다.
그리고 반응물의 농도를 계산할 때 많이들 하는 실수가 반응하고 나서의 농도를 구하려고 하는 점입니다. 이는 완전한 오개념입니다. 반응속도는 반응하기 전! 즉 반응물들의 농도에 의해 결정이 됩니다. 따라서 반응시키기 전 농도를 구해줘야함을 꼭 기억해야합니다. 이때 플라스크에 KCl과 (NH4)2SO4를 넣으면서 I-와 S2O8^2- 농도가 묽혀지게 됩니다. 그래서 묽힘 공식을 이용해 반응시키기 전 각각의 플라스크에 들어있는 농도를 구해주면 됩니다.
참고문헌
표준일반화학실험, 대한화학회, 201~207p
