1. 목적
: 산화·환원 적정의 원리를 이해하여 과망가니즈산 적정법으로 과산화수소의 양을 측정할 수 있다.
2. 기구&시약
- 시약 : 옥살산 나트륨(Na₂C₂O₄ 분말 1g), 과망가니즈산 칼륨(KMnO₄ 0.1M, 갈색병 500mL), 과산화 수소수(3%, 30mL), 황산(증류수로 1:1희석한 것, 100mL)
- 기구 : 비커(100mL, 2개), 씻기병(1개), 부피 플라스크(100mL, 2개), 뷰렛(50mL, 1개), 삼각 플라스크(250mL, 2개), 부피 피펫(10mL 2개, 5mL 1개), 깔때기(1개), 자석 교반기(가열되는 것, 1대)
3. 원리
(1) 산화·환원 반응 : 화합물 사이에 전자가 옮겨가는 반응
- 산화 : 전자를 잃음
- 환원 : 전자를 받음
- 환원제 : 전자를 내어 주어서 자신은 산화되고 다른 화합물을 환원시키는 화합물
- 산화제 : 전자를 받음으로써 자신은 환원되고 다른 화합물을 산화시키는 화합물
▷ 산화·환원 반응은 산·염기 반응과 마찬가지로 정량적으로 일어나기 때문에 시료의 농도를 알아내는 부피 분석법으로 활용될 수 있다. 농도를 정확하게 알 고 있는 산화제 또는 환원제의 표준 용액으로 시료를 완전히 산화 또는 환원시키는 데 필요한 양을 측정하면 시료에 들어있는 물질의 농도를 알아낼 수 있다.
(2) 산화·환원 적정
- 산화제 또는 환원제의 표준 용액으로 시료물질을 완전히 산화 또는 환원시키는 데 소모된 양을 측정하여 시료물질을 정량하는 방법
- 산화·환원 반응에서 서로 주고받은 전자의 수는 같으므로 표준 용액에서 잃거나 얻은 전자의 몰수를 알아내어 미지 용액이 잃거나 얻은 전자수를 계산해서 미지 물질의 농도를 알아내는 방법
- 당량 : 산화·환원 반응에서 산화제나 환원제가 전자 1몰을 내놓는 양(그램당량 : 1당량에 해당하는 질량을 그램 단위로 나타낸 값)
- 당량점 : 산화·환원 적정법에서 산화제와 환원제가 화학 양론적으로 반응이 완결되는 지점, 하지만 실제로 당량점은 직접 관찰할 수 없으므로 지시약이나 전압의 변화 등을 이용해서 종말점으로 확인
- 산화·환원 반응의 동시성

(3) 과망가니즈산 적정법
- 과망가니즈산 칼륨 : 산화·환원 적정에서 가장 많이 사용하는 산화제 중의 하나
| - 산성용액 : MnO₄⁻ + 8H⁺ + 5e⁻ → Mn²⁺ + 4H₂O - 염기성이나 중성 용액 : MnO₄⁻ + 2H₂O + 3e⁻ → MnO₂ + 4OH⁻ |
- 산성 용액에서 과망가니즈산 이온이 Mn²⁺이온으로 환원되면서 일으키는 강력한 산화작용에 의해 시료를 산화한다. 위 반응식에서 과망가니즈산 이온 1몰이 전자 5몰을 받아들였으므로 과망가니즈산 칼륨 1몰은 5당량이다
- 염기성이나 중성 용액에서는 과망가니즈산 이온 1몰이 전자 3몰을 받아들였으므로 3당량으로 작용
- 과망가니즈산 이온은 보라색을 띠는데 환원되면 갈색이 된다. 따라서 시료의 산화가 모두 끝나면 보라색이 남아 있게 되어 종말점을 알 수 있다.
(4) 실험 반응
옥살산 나트륨을 일차 표준 물질로 하여 과망가니즈산 칼륨 용액의 농도를 표준화하고(과망가니즈산 칼륨은 순수한 상태로 얻기가 어렵고 대부분의 경우에 소량의 이산화망간이 들어있어서 옥살산 나트륨, 옥살산, 산화 비소, 순수한 철, 모어염과 같은 일차 표준 물질로 표준화해야만 한다), 이 용액을 이용하여 과산화 수소 수용액을 정량한다.
| - 옥살산 나트륨 : 과망가니즈산 칼륨과 다음과 같이 반응하므로 1몰이 2당량이다. 2MnO₄⁻ + 5C₂O₄²⁻ + 16H⁺ → 2Mn²⁺ + 10CO₂ + 8H₂O - 과산화 수소 : 산성 용액에서 과망가니즈산 칼륨에 의하여 다음과 같이 산화되므로 과산화 수소 1몰은 2당량이다. 2MnO₄⁻ + 5H₂O₂ + 6H⁺ → 2Mn²⁺ + 5O₂ + 8H₂O |
▷ 과망가니즈산 이온과 과산화수소는 2:5의 비로 반응하며, 용액 속의 과산화수소가 모두 산화되어 Mn²⁺ 이온이 된 후에는 용액 속에 과망가니즈산 이온의 엷은 자주색이 나타나게 되어서 종말점 결정에 이용할 수 있다.
4. 유의사항
- KMnO₄ 용액은 햇빛을 받으면 분해되기 때문에 갈색 시약병에 보관하는 것이 좋다.
- 종말점에서 색깔을 정확하게 알아내기 위해서 250mL 삼각 플라스크에 같은 부피의 증류수를 담고 과망가니즈산 칼륨 용액 한 방울을 넣은 용액을 준비해두면 좋다.
5. 실험과정
* 주의: 실험과정 및 계산에서 과망가니즈산 칼륨 용액의 농도를 서울특별시교육청에서 발간한 화학실험 책을 기준으로 따랐습니다. 또한 (2)에서 일반화학실험 책을 쓰시는 분들은 과산화수소 농도를 20배 묽혔으니 계산 다르게 하셔야 합니다!
(1) 0.1M 과망가니즈산 칼륨 용액의 표준화
- 뷰렛에 깔때기를 이용해 0.1M 과망가니즈산 칼륨 용액을 채우고 눈금을 읽는다.
- 옥살산 나트륨(Na₂C₂O₄) 0.700g을 비커에서 소량의 증류수로 녹인 후 100mL 부피 플라스크에 넣고 비커를 증류수로 헹구어서 넣고 눈금까지 증류수를 채운 다음 흔들어준다.
- 과정 2의 옥살산 나트륨 용액 10.0mL를 부피 피펫으로 정확히 취하여 250mL 삼각 플라스크에 넣고 증류수 약 60mL를 더 넣어준다. 그리고 황산과 증류수 1:1 희석액 5mL를 가한다.
- 과정 3의 삼각 플라스크를 자석교반기 위에서 물중탕으로 가열하며 저어준다. 이때 물의 온도가 70~80°C로 유지되기 주의한다.
- 뷰렛의 용액을 가하며 자석교반기로 저어주어 색깔이 30초 이상 없어지지 않고 지속되는 지점을 종말점으로 본다.
- 과정 3~5까지 2회 더 반복한다.
(2) 과망가니즈산 적정법에 의한 과산화수소 수용액의 정량
- 뷰렛에 깔때기를 이용해 과망가니즈산 칼륨 용액을 채우고 눈금을 읽는다.
- 3% 과산화 수소수 10.0mL를 부피 피펫으로 정확하게 취하여 100mL 부피 플라스크에 넣고 눈금까지 증류수를 채운 다음 흔들어준다. COMMENT: 3% 과산화수소를 10배 희석하였으므로 적정으로 구한 농도에 10배를 해줘야 구하고자 하는 과산화수소의 농도가 됨!, 일반화학실험에서는 5mL를 취해 100mL 표지선까지 물을 채웠으므로 총 20배 희석되었으니 실험결과에서 20배 곱해줘야합니다!
- 과정 2의 과산화 수소 수용액 5.0mL를 부피 피펫으로 정확히 취하여 250mL 삼각 플라스크에 넣고 증류수 95mL를 가해 약 100mL가 되게 한 후 황산 1:1 희석액 10mL를 가한다.
- 상온에서 자석교반기로 저어주며 과망가니즈산 칼륨 용액으로 적정한다.
- 과정 3~4를 2회 더 반복한다.
6. 실험결과
(1). 0.1M 과망가니즈산 칼륨 용액의 표준화
- 옥살산 나트륨의 농도(M) : 0.052M
- 옥살산 나트륨 수용액의 부피(mL) : 10.0 mL
- 소비된 과망가니즈산 칼륨 용액의 부피(mL) : 4.9mL
- (이론값 : 2 * 0.052M * 10.0 mL = 5 * 0.1 * V, V = 2.0 mL)
- 과망가니즈산 칼륨 표준 용액의 농도 : 0.042M
- 2MnO₄⁻ + 5C₂O₄²⁻ + 16H⁺ → 2Mn²⁺ + 10CO₂ + 8H₂O
- 2*0.052M*10.0mL = 5*[KMnO4]*4.9mL
- [KMnO4] = 0.042M
(2) 과망가니즈산 적정법에 의한 과산화 수소 수용액의 정량
- 과망가니즈산 칼륨 표준 용액의 농도(M) : 0.042M
- 소비된 과망가니즈산 칼륨 표준 용액의 부피(mL) : 3.6 mL
- 소비된 과망가니즈산 칼륨 표준 용액의 부피
2MnO₄⁻ + 5H₂O₂ + 6H⁺ → 2Mn²⁺ + 5O₂ + 8H₂O
- 5 * 0.042M * 3.6mL = 2 * [H2O2]' * 5mL
- [H2O2]' = 0.076M
- n(H2O2) = 0.38mmol
(3) 과정 2에서 가한 3% 과산화 수소수의 몰농도를 계산해보자.
- [H2O2]' = 0.076M, 이것은 10분의 1로 희석한 것을 적정한 것의 결과이므로
- 3% 과산화 수소의 몰농도는 0.76M
(4) 과정 2에서 가한 3% 과산화 수소수의 %농도를 계산하고 오차를 구해보자.
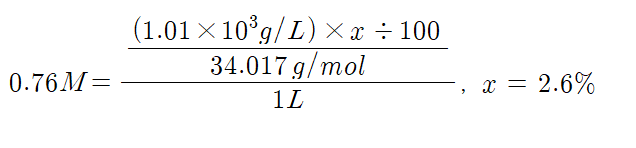
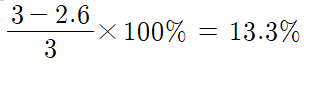
7. 생각해볼사항(고찰)
(1) 옥살산 나트륨으로 과망가니즈산 칼륨 용액의 농도를 결정할 때 처음에는 탈색되는 데 시간이 걸리다가 일단 반응이 시작되면 원활하게 탈색이 진행되는 이유를 설명해보자.
- 옥살산 나트륨과 과망가니즈산 칼륨 용액의 반응은 다음과 같다.
- 2MnO₄⁻ + 5C₂O₄²⁻ + 16H⁺ → 2Mn²⁺ + 10CO₂ + 8H₂O
- 일반적으로 이 반응은 속도가 느리지만, 생성된 Mn2+이온이 반응 촉매로 작용할 수 있어 시간이 지나 Mn2+의 농도가 증가하면 이 반응의 속도가 빨라진다.
(2) 옥살산 나트륨으로 과망가니즈산 칼륨 용액의 농도를 결정할 때 온도를 70~80°C로 유지해야 하는 이유를 설명해보자.
- 두 용액 간 반응은 느리지만 온도를 높여주면 활성화 에너지 이상의 에너지를 갖는 분자가 많아지므로 반응속도가 증가한다. 그러나 온도가 너무 높으면 과망가니즈산 칼륨이 아래 식과 같이 분해될 수 있어 온도를 70~80°C로 유지한다.
- 2KMnO4 → K2MnO4 + MnO2 + O2
(3) 과망가니즈산 칼륨 적정을 산성 용액에서 행할 때 염산이나 질산을 사용하지 않고 황산 용액을 사용하는 이유를 설명해보자.
* 산성 용액에서 하는 이유 : H+ 공급, MnO4 생성 억제
1) HCl을 사용할 경우 : Cl-가 MnO4-에 의해 산화되어 유독한 Cl2 기체 발생
2) 질산을 사용할 경우 : NO3-가 환원되어 NO2 기체 발생
3) 황산을 사용할 경우 : 짝염기인 SO42-가 다른 산의 음이온보다 반응성이 작아 MnO4-이온과 반응을 일으키지 않으므로 황산 용액을 사용한다.
(4) 적정을 하기 전에 시료 용액을 증류수로 묽히는 이유를 설명해보자.
과산화수소의 분해반응은 심한 발열 반응을 나타내기 때문에 농도를 작게하기 위함이다.
(5) 과산화 수소수의 농도 측정에서 오차가 나는 이유를 설명해보자.
1) 과망가니즈산의 광분해 : 과망가니즈산은 빛에 노출되면 자연적으로 광분해가 일어나므로 시간이 지날수록 농도가 감소하여 계산 결과가 실제보다 크게 나올 수 있다.
- 2KMnO4 → K2MnO4 + MnO2 + O2
2) 과산화 수소의 분해 : 과산화수소 또한 공기와 접촉하여 쉽게 물과 산소로 분해된다. 따라서 과산화수소는 3%보다 농도가 작을 수 있다.
3) 과산화수소와 MnO4-의 불균등화 반응이 농도에 영향을 줄 수 있다.
(6) Fe²⁺와 Fe³⁺이온의 혼합물인 철의 산화물을 포함한 철광석을 산성 용액에 녹여 있는 철을 Fe²⁺이온으로 환원시킨 후에 과망가니즈산 칼륨 표준 용액으로 적정을 하면 광석에 들어있는 철의 양을 알아낼 수 있다. 철광석 시료 0.350g을 산성 용액에 녹이면 모든 철은 Fe²⁺로 환원된다. 그런 후에 1.621×10⁻²M의 KMnO₄ 용액으로 적정을 하였더니 엷은 자주색의 종말점까지 과망가니즈산 용액 41.56mL가 소비되었다. 철광석에 들어있는 철의 무게 퍼센트를 계산하여라.
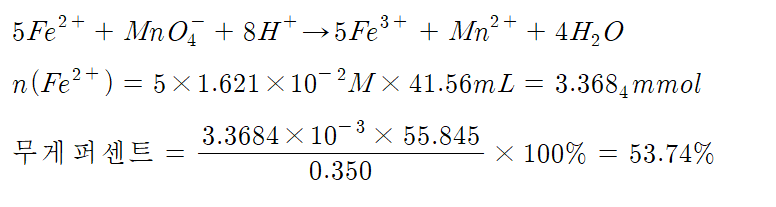
참고문헌
화학실험, 서울특별시교육청
표준일반화학실험 제 7판, 대한화학회
'일반화학실험' 카테고리의 다른 글
| [표준일반화학실험] 22. 평형 상수와 용해도곱 결정 레포트(2) (1) | 2022.04.09 |
|---|---|
| [표준일반화학실험] 21. 센물 분석 실험 레포트 (0) | 2022.04.09 |
| [표준일반화학실험] 13. 생활 속의 산-염기 분석(산염기 적정) 실험 레포트 (1) | 2021.10.24 |
| [표준일반화학실험] 12. 엔탈피 측정 실험 레포트(미완성) (0) | 2021.10.24 |
| [일반화학실험] 8. 크로마토그래피 레포트 (1) | 2021.10.02 |